Os átomos podem ser descritos por métodos matemáticos através da teoria quântica. Com o auxílio desta teoria, utilizando-se métodos aproximativos e cálculos computacionais, é possível fazer previsão do comportamento destes sistemas com grande precisão.
Hoje também se sabe que o átomo não é a unidade mais básica formadora da matéria. Na linguagem moderna da física, o átomo é constituído por certas partículas elementares (os tipos e classificação destas partículas será assunto de uma outra postagem). O que é interessante é o fato de que tentar entender de que é feita a matéria é uma questão que remonta a milhares de anos e, pelo menos no que diz respeito aos gregos, ficou registrado o que eles pensavam sobre o assunto.
Num breve resumo sobre as ideias dos filósofos pré-socráticos podemos dizer que Tales acreditava que a água fosse a substância fundamental. Para Anaxímenes era o ar e para Heráclito era o fogo. Empédocles acreditava na existência de quatro elementos básicos - terra, água, ar e fogo; a mistura e separação destes elementos pela ação do Amor e do Conflito produziria todas as substâncias do mundo. Para Anaxágoras existia uma infinita variedade de "sementes" e para Leucipo e Demócrito, a substância fundamental era o "átomo", eterno e indestrutível, mas com um tamanho finito (portanto, bem diferente do átomo tal como é descrito pela ciência física atual). Para Anaximandro existiria uma "substância" diferente de tudo conhecido que seria infinita, eterna e indestrutível e que envolveria o mundo. Algumas destas ideias podem ser correlacionadas com ideias da física moderna mas, evidentemente, estão bastante distantes de fornecerem um entendimento dos átomos e moléculas e, mais importante ainda, de fornecer informações quantitativas sobre sistemas físicos. São ideias filosóficas, que tiveram importância primária na construção de concepções sobre o mundo, mas apenas importância secundária quando da construção dos modelos matemáticos que descrevem os sistemas atômicos estudados pela física moderna. Posteriormente Platão associou os sólidos regulares aos quatro elementos (terra - cubo; ar - octaedro, fogo - tetraedro, água - icosaedro) de tal forma que existia a crença de que as menores porções de matérias seriam formas matemáticas.
Durante os próximos séculos a sombra dos filósofos gregos irá pairar sobre o pensamento do mundo ocidental, de tal forma que não surgirão grandes novas ideias a respeito do tema (em outra postagem falarei sobre o pensamento pós-Platão até chegarmos ao século XX).
O século XIX foi rico em ideias e descobertas relacionadas com a física. Na virada do século XX, as teorias da mecânica, da termodinâmica e do eletromagnetismo estavam bem estabelecidas, de tal modo que os cientistas puderam voltar seus olhares novamente ao problema do átomo. O problema da radiação do corpo negro (ver a nossa postagem "
Qual a origem da teoria quântica?", novembro/2012) e que aparentemente nada tem a ver com a questão do átomo desempenhará um papel fundamental para o seu entendimento.
Mas retornemos aos modelos atômicos. No começo do século XX, mais precisamente em 1904, Lenard propôs um modelo de átomo no qual as cargas positivas e negativas estavam emparelhadas e distribuídas em todo o seu volume. Esse modelo foi descartado porque não explicava as ligações químicas, por exemplo. Em 1905 J.J. Thomson propôs um outro modelo no qual existia um fluido com a maior massa do átomo, bem como as cargas positivas. Nesse fluido estavam espalhados os elétrons que possuem a carga negativa. Através de cálculos bastante elaborados, Thomson mostrou que o seu modelo explicava a radiação, explicava as ligações químicas, poderia caracterizar os elementos químicos, mas não explicava nem os espectros atômicos, nem o espalhamento de Rutherford.
O espalhamento de Rutherford foi um experimento fundamental para se entender como são distribuídas as cargas positivas e negativas em um átomo. Fazendo o espalhamento de partículas alfa em folhas finas de ouro, Geiger e Marsden, sob a orientação de Rutherford chegaram à conclusão de que o átomo era composto de um núcleo onde estava concentrada a carga positiva, enquanto que a carga negativa (os elétrons) giravam em torno do núcleo. Como principal falha, o modelo de Rutherford afirmava que o elétron estava girando ao redor do núcleo e, portanto, tinha uma aceleração a= v.v/r, o que implicava que ele estaria emitindo radiação. Logo, ele estaria perdendo energia e seu raio estaria continuamente diminuindo de tamanho. Era um modelo de átomo instável. O modelo de Rutherford também não explicava o espectro do hidrogênio.
Sabia-se que quando o gás hidrogênio recebia uma descarga elétrica, ele emitia luz numa impressionante regularidade quando analisada por um espectrômetro. Balmer descobriu uma fórmula que dava os comprimentos de onda (lambda) das linhas do espectro:
lambda = 3645,6 . 10^(-8) . [(n.n)/(n.n-4] cm , com n = 3, 4, ....
Posteriormente, Rydberg e Ritz descobriram que havia uma expressão mais geral dada por:
1/ lambda = R {[1/(n0.n0)] -[1/(n.n)]}, onde n = n0 + 1, n0 + 2,....
onde R dependia do elemento e o n0 caracterizava as diversas séries. Eles sugeriram que a fórmula de Balmer era um caso particular quando n0 = 2, existindo também n0 = 1, 3,4,... De fato, posteriormente descobriu-se a existência das outras séries, de tal modo que:
n0 = 1: série de Lymann
n0 = 2: série de Balmer
n0 = 3: série de Paschen
n0 = 4: série de Brackett
n0 = 5: série de Pfund.
Em 1913 Niels Bohr expôs um modelo atômico edificado sobre três postulados que em resumo dizia que existiam estados estacionários onde os átomos não emitem radiação; as forças sobre os elétrons associadas com a emissão de radiação é negligenciável. Segundo Dirac, estas ideias foram os maiores passos em todo o desenvolvimento da mecânica quântica. Os postulados podem ser expressos da seguinte forma:
Postulado I: Os elétrons movem-se em órbitas circulares em torno do núcleo de acordo com a mecânica clássica, mas sem irradiar.
F = [Z.e^2]/[4.(pi).
e0.r^2] = m.v^2/ r => v = {Z.e^2/[4.(pi).e0.r.m]}^(1/2) Eq. (1)
(Nesta equação Z é o número atômico, "e" é a carga do elétron,
e0 é a constante dielétrica do vácuo, m é a massa do elétron, r é o raio da órbita do elétron em torno do núcleo e v é a velocidade do elétron).
Postulado II: Só são permitidas órbitas eletrônicas em que o momentum angular é um múltiplo inteiro de {h/[2.(pi)]}, onde h é a constante de Planck.
L = m.v.r = n. h/[2.(pi)] => v = n . h/[2.(pi).r
.m] Eq (2)
Igualando as equações 1 e 2, obtém-se:
v = {Z.e^2/[4.(pi).
e0.r.m]}^(1/2) = n.h/[2.(pi).r.m] => r(n) = [n^2.h^2. e0]/[Z.(pi).m.e^2]
Mas a energia total do sistema, como é conhecido, é a soma da energia potencial mais a energia cinética, de tal forma que E = Ep + Ec. Entretanto:
Logo:
Ep = - Z.e^2/[4.(pi).
e0].[1/r] (infinito a r) = - Z.e^2/[4.(pi).e0.r]
Ek = (1/2). m.v^2 = (1/2).{Z.e^2/[4.(pi).
e0.r]}
E = Ep + Ek = - Z.e^2/[8.(pi).
e0.r]
Assim, E(n) = - Z.e^2/[8.(pi).
e0.{[n^2.h^2. e0]/[Z.(pi).m.e^2]}
E(n) = - Z.e^4.m/[8.(pi).e0.n^2.h^2]
Vemos por esta última equação que para um átomo, a energia do elétron só depende do nível onde está localizado este elétron. Assim, para o átomo, E = - b/n^2. Quanto maior for o "n", maior será o valor da energia, pois a fração é negativa.
Postulado III: O elétron não irradia energia se permanece em um determinado nível; a radiação ocorre apenas quando o elétron passa de um estado de energia alto para um baixo estado de energia.
Ou seja, a frequência da radiação emitida, ao elétron passar de um nível n0+1 para n, n0+2 para n, etc, corresponde aos comprimentos de onda das linhas do espectro para a série de n0.
Para um átomo de hidrogênio estas ideias eram boas mas, como desenvolver a ideia das órbitas de Bohr para átomos mais complicados? Heisenberg, então, sugeriu que as grandezas importantes na teoria física são "coisas" observáveis ou "coisas" relacionadas a quantidades observáveis. Esses observáveis estariam associados a duas órbitas de Bohr e não a apenas uma. Todas as quantidades de uma certa espécie associada com duas órbitas são expressas na forma de uma matrtiz. Cada variável dinâmica como posição e momentum da teoria Newtoniana foi associada a uma matriz. Mas matrizes envolvem uma álgebra não comutativa e Heisenberg chegou ao resultado constrangedor de que as variáveis dinâmicas obedeciam a uma tal álgebra. Através da formulação Hamiltoniana, as equações de Newton que podiam ser escritas através do parêntese de Poison [a, b] foram substituídas pelas equações de Heisenberg, com o análogo do parêntese de Poisson escrito como [(ab-ba).2(pi)/i.h], onde i é o número imaginário complexo e h, novamente, a constante de Planck. Classicamente as variáveis dinâmicas u eram escritas como du/dt = [u, H], sendo agora substituídas pela equação:
du/dt = (2.pi) [uH - Hu]/i.h
E a interpretação para estas equações? Quase que simultaneamente à construção do formalismo de Heisenberg, Schrödinger desenvolveu uma formulação diferente da mecânica quântica, embora pouco depois tenha sido mostrado que as duas formulações eram equivalentes (ver a postagem Heisenberg vs. Schrödinger, de 13/03/2013, neste blog). Schrödinger baseou-se na associação feita por De Broglie de uma onda plana movendo-se numa direção definida com frequência definida a uma partícula com momentum e energia definidas, na qual não atuavam forças. Na verdade, Schrödinger generalizou para o caso de um elétron movendo-se sob a ação de forças elétricas e magnéticas. À partícula estava associada uma função de onda Psi(x1, x2, x3, t) e existiam operadores atuando sobre Psi: p, o momentum, e x, a posição. Estas quantidades obedecem a regras de não-comutatividades análogas aos operadores de Heisenberg e daí é fácil estabelecer-se a conecção entre as duas teorias. Psi representa um estado do sistema. Os operadores que mudam uma função de onda em outra, estão associados aos dois estados. A interpretação desta formulação é que o módulo quadrado de Psi, ou seja, |Psi|^2, é a probabilidade da partícula ser encontrada em uma determinada posição.
Segundo Schrödinger, uma partícula que se encontra submetida a um potencial V será regida por uma equação do tipo:

,
que é exatamente a chamada equação de Schrödinger. Esta é uma equação que os matemáticos classificam como uma equação diferencial parcial. No caso em que a função de onda psi, que a princípio é função de r e de t, é independente do tempo, a equação de Schrödinger pode ser expressa de uma forma mais simples:
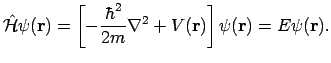
Na equação acima,
E representa a energia do sistema. Admitindo que o elétron pertencente ao átomo de hidrogênio esteja num potencial central eletrostático:
V(r) = - e^2/[4.(pi).e0.r].
Um sistema de coordenadas apropriado para trabalhar o problema do elétron no átomo de hidrogênio é o chamado "coordenadas esféricas". Neste sistema qualquer ponto do espaço pode ser localizado pelas coordenadas r, teta e phi, ou seja, uma coordenada (r) que diz o valor da distância do ponto em consideração até a origem do sistema de coordenadas, e duas coordenadas angulares (teta e phi). A figura abaixo fornece uma representação do sistema de coordenadas esféricos, mostrando que ele é equivalente ao mais comumente utilizado sistema de coordenadas retangulares (x, y, z).
Utilizando-se o sistema de coordenadas esféricas a equação de Schrödinger poderá ser resolvida separando-se a solução psi numa parte dependente das coordenadas angulares e numa parte dependente apenas da coordenada r, ou seja,
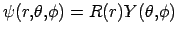
Substituindo esta solução tentativa na equação de Schrödinger, teremos:

Resolvendo-se a parte angular inicialmente, poderemos separar a equação adicionalmente numa parte em phi e numa parte em teta. No que diz respeito à primeira coordenada a equação fica da forma:

A solução para a equação acima é:

Entretanto, nem todos os valores de m são permitidos. Para a solução ser fisicamente aceitável, phi (2.pi + phi´) = phi (phi´). Isso implica que m pode assumir os valores 0, 1, -1, 2, -2, 3, -3, etc. Por outro lado a equação em teta fornece como solução os polinômios associados de Legendre. Juntando-se, então, as soluções para a parte relativa às coordenadas angulares encontra-se que:

onde a função Y são os chamados harmônicos esféricos.
A solução formal da equação tem uma aparência um pouco complicada, dada por;
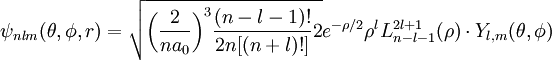
onde n, m, l são números inteiros, Y, como falado, são os chamados harmônicos esféricos, rho é uma função da coordenada r e L são os polinômios associados de Laguerre. A solução da parte radial é uma equação diferencial cuja solução só é bem comportada a grandes distâncias se:
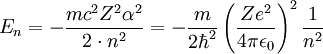
Esta equação fornece a energia do elétron no átomo de hidrogênio, que se coaduna bastante bem aos resultados experimentais. Assim, o formalismo de Schrödinger da mecânica quântica reproduz o resultado experimental relacionado ao átomo de hidrogênio.
Lembrando que para Platão as menores porções da matéria seriam formas matemáticas, admitindo que a função de onda Psi seja o que melhor temos para representar um elétron no átomo de hidrogênio, poderemos achar que o mundo foi bem traduzido por Platão, não?
 (1)
(1)

