O carbono é o elemento químico que forma o maior número de substâncias conhecidas. No estado fundamental ele apresenta uma configuração eletrônica 1s2
2s2 2p2, o que sugeriria que o carbono poderia ser, do ponto de vista químico, divalente. Isso seria consequência dos dois elétrons p poderem formar ligações químicas com outros elementos. Entretanto, o carbono pode formar também ligações trivalentes e tetravalentes e esta habilidade advém do fato de que ele pode sofrer hibridização dos seus orbitais. Mas, o que significa hibridização?
Para entender isso, inicialmente consideremos a distribuição dos elétrons em termos dos orbitais do átomo de carbono no seu estado fundamental. Ele seria distribuído de acordo com a representação esquemática da Figura 1, onde as letras s e p estão relacionadas ao momento angular dos elétrons e as setas representam o spin dos elétrons.


Para entender isso, inicialmente consideremos a distribuição dos elétrons em termos dos orbitais do átomo de carbono no seu estado fundamental. Ele seria distribuído de acordo com a representação esquemática da Figura 1, onde as letras s e p estão relacionadas ao momento angular dos elétrons e as setas representam o spin dos elétrons.
Figura 1: Distribuição dos elétrons do carbono no estado fundamental. As letras s e p estão associadas ao momento angular do elétron, enquanto as setas representam spin positivo (seta para cima) ou spin negativo (seta para baixo).
Da
Mecânica Quântica se sabe que em cada orbital, ou seja, que em cada estado físico
caracterizado por um determinado valor de energia e um determinado valor de
momento angular orbital, podem estar presentes dois elétrons, cada um com um
determinado spin [1]. Quando os níveis energéticos estão próximos,
eventualmente, eles podem ser combinados para formar orbitais híbridos. Na
hibridização sp, um orbital s se combina com um orbital px, enquanto que no orbital sp2 um
orbital s se combina com um orbital px e com um orbital py. Finalmente, na hibridização sp3 um
orbital s se combina com um orbital px, com um orbital py e com um orbital pz. Tecnicamente, neste último caso em particular, cada novo orbital
hibridizado é uma combinação linear das funções de onda dos diversos orbitais s e p.
Numa representação esquemática a hibridização sp3 pode ser apresentada pelo desenho da Figura 2.
Figura
2: Distribuição dos elétrons do carbono hibridizado sp3. A energia dos elétrons assume um valor intermediário entre os
níveis 2s e o 2p.
Por causa do efeito da hibridização, o carbono pode formar ligações químicas com até quatro outros elementos químicas. Consideremos, por exemplo, o gás metano CH4; neste caso o carbono forma quatro ligações simples com quatro diferentes átomos de hidrogênio. No diamante o carbono também está ligado a quatro outros átomos de carbono através de ligações simples do tipo sp3 (Figura 3). Outras estruturas de carbono menos conhecidas são os chamados fulerenos, que foram descobertos em 1985 por Kroto e outros. O membro mais conhecido da família dos fulerenos é o C60, uma estrutura que possui 60 átomos de carbono com hibridização do tipo sp2 localizados nos vértices de 20 hexágonos e 12 pentágonos, formando uma figura geométrica conhecida como icosaedro, semelhante a uma bola de futebol. Outra forma alotrópica do carbono é o nanotubo, que pode ser visto como uma camada de carbono enrolada sobre si mesma, formando um cilindro cujo diâmetro geralmente está entre 0,5 e 2,5 nanômetros.
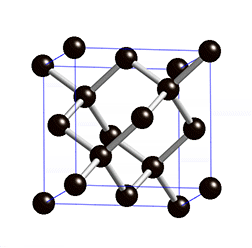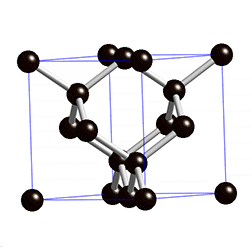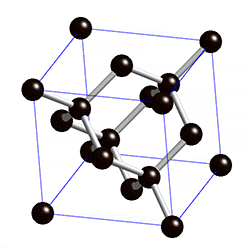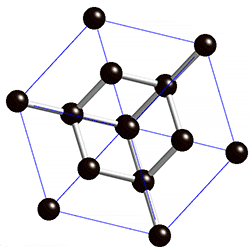
Figura 3: Estrutura do diamante, mostrando que cada átomo de carbono se liga a outros quatro átomos de carbono.
Esta capacidade do carbono se ligar com ligações simples, duplas e triplas com átomos de hidrogênio, além de átomos de oxigênio, nitrogênio e enxofre, entre outros, formando substâncias de longas cadeias faz com que o número de substâncias formadas apenas pelo carbono - incluindo-se aí as complexas moléculas envolvidas no metabolismo da vida - seja incrivelmente grande. Estima-se que existam cerca de um milhão destas substâncias, e o seu estudo compõe o campo da química orgânica [2].
Vamos tentar entender o significado dos quadrados no desenho da Figura 2. Existe um princípio físico denominado de "princípio de exclusão de Pauli" que afirma que para cada estado de energia permitido a um elétron, só é possível estarem presentes apenas dois elétrons, um com spin positivo e outro com spin negativo. Como consequência, como existem quatro orbitais com um único elétron cada um, quatro outros elétrons da 'camada' externa de outros átomos podem se unir a estes orbitais formando quatro ligações químicas. É esta razão pela qual cada carbono do metano faz ligação com quatro átomos de hidrogênio e no diamante cada carbono se liga a quatro outros átomos de carbono.
Uma maneira de descobrir como são as ligações químicas formadas pelo carbono (na verdade, formadas por quase todos os elementos químicos) é utilizar algum método espectroscópico. Uma técnica bastante utilizada atualmente em laboratórios é a chamada espectroscopia Raman. Nesta técnica, a luz de um laser é espalhada pelo material que está sendo investigado e, a seguir, analisada em um espectrômetro [3]. Dependendo do tipo de ligação os espectros apresentarão bandas em diferentes regiões espectrais. Por exemplo, se o material é grafite, aparecerá uma banda em 1580 cm−1 [4]; se for diamante, aparecerá no espectro Raman uma banda em 1322 cm−1. Se o material apresentar desordem a interpretação do espectro Raman relacionado pode ser bem mais complicada, mas sempre é possível chegar a um bom entendimento do sistema [5].
As diferentes formas de carbono podem ser modificadas, eventualmente, pela aplicação de temperatura e pressão. O caso mais conhecido é o do grafite que sob condições simultâneas de altas temperaturas e altas pressões se transforma em diamante. Já sob temperatura ambiente observou-se que em cerca de 17 GPa (aproximadamente 170 vezes a pressão reinante no fundo do oceano) metade das ligações π entre as camadas de grafite é convertida em ligações σ [6]. Outras medidas mostram que em torno de 10 GPa começam a se formar ligações do tipo sp3 [7] e que, partindo-se de monocristais de grafite, medidas óticas segerem a formação de uma fase transparente em 18 GPa [8]. Teoricamente, outras transformações mais exóticas também podem ocorrer. Por exemplo, cálculos teóricos sugerem que duas camadas de grafeno (que se constitui numa única camada do grafite) poderiam se transformar sob pressão em um diamante hidroxilado bidimensional - um diamandol - se uma das camadas fosse coberta com grupos hidroxílicos [9]. Outras possibilidades também podem ser encontradas.
Uma maneira de descobrir como são as ligações químicas formadas pelo carbono (na verdade, formadas por quase todos os elementos químicos) é utilizar algum método espectroscópico. Uma técnica bastante utilizada atualmente em laboratórios é a chamada espectroscopia Raman. Nesta técnica, a luz de um laser é espalhada pelo material que está sendo investigado e, a seguir, analisada em um espectrômetro [3]. Dependendo do tipo de ligação os espectros apresentarão bandas em diferentes regiões espectrais. Por exemplo, se o material é grafite, aparecerá uma banda em 1580 cm−1 [4]; se for diamante, aparecerá no espectro Raman uma banda em 1322 cm−1. Se o material apresentar desordem a interpretação do espectro Raman relacionado pode ser bem mais complicada, mas sempre é possível chegar a um bom entendimento do sistema [5].
As diferentes formas de carbono podem ser modificadas, eventualmente, pela aplicação de temperatura e pressão. O caso mais conhecido é o do grafite que sob condições simultâneas de altas temperaturas e altas pressões se transforma em diamante. Já sob temperatura ambiente observou-se que em cerca de 17 GPa (aproximadamente 170 vezes a pressão reinante no fundo do oceano) metade das ligações π entre as camadas de grafite é convertida em ligações σ [6]. Outras medidas mostram que em torno de 10 GPa começam a se formar ligações do tipo sp3 [7] e que, partindo-se de monocristais de grafite, medidas óticas segerem a formação de uma fase transparente em 18 GPa [8]. Teoricamente, outras transformações mais exóticas também podem ocorrer. Por exemplo, cálculos teóricos sugerem que duas camadas de grafeno (que se constitui numa única camada do grafite) poderiam se transformar sob pressão em um diamante hidroxilado bidimensional - um diamandol - se uma das camadas fosse coberta com grupos hidroxílicos [9]. Outras possibilidades também podem ser encontradas.
Referências e notas:
[1] No começo do desenvolvimento da teoria quântica, ficou claro que o elétron possuía uma propriedade importante denominada de spin. A descrição matemática desta grandeza física é relativamente complicada, mas a sua visualização pode ser inferida por experimentos simples. Consideremos um feixe de elétrons, ou um feixe de átomos que possui spin diferente de zero. Este feixe é emitido por um canhão de elétrons e, à princípio, ele se movimentará em linha reta. Entretanto, se os elétrons que foram emitidos penetrarem uma região do espaço onde se encontra um campo magnético não uniforme, os elétrons serão defletidos para um lado ou para o outro num plano perpendicular ao campo magnético (como o elétron também possui um momento magnético, m, associado, o campo não-uniforme implicaria numa distribuição espacial contínua para os elétrons do feixe). Como o momento magnético do elétron é proporcional ao valor do spin, m ~ s, o campo magnético exerce uma influência sobre o elétron através do seu momento magnético que, em última análise, está relacionado ao seu spin. O fato dos elétrons poderem ser separados em dois feixes indica que, para eles, existem dois tipos de spin, um positivo e um negativo. Na linguagem que os físicos gostam de usar:
s = + ħ/2 ou s = - ħ/2,
[2] Química Orgânica.N.I. Allinger, M.P. Cava, D.C. de Jongh, C.R. Johnson, N.A. Lebel, C.L. Stevens, Ed. LTC.
[3] Um espectrômetro, fundamentalmente, separa a luz em diversos comprimentos de onda, cada comprimento de onda associado a uma cor. Depois que essa luz é separada ela é detectada através de um sistema - fotomultiplicadora ou sistema CCD - que é sensível aos vários comprimentos de onda, nos casos mais comuns, abrangendo a região do infravermelho ao ultravioleta, passando pela luz visível.
[4] A unidade cm−1 é a mais utilizada pelos espectroscopistas. A grosso modo, essa unidade corresponde ao inverso do comprimento de onda, ou seja, 1/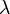 .
.
[5] Raman of disordered amorphous and diamondlike carbon, A.C. Ferrari, J. Robertson, Physical Review B 64, 075414 (2001).
[6] Bonding changes in compressed superhard graphite. W.L. Mao et al. Science 302, 425 (2003).
[7] Graphite under pressure: equation of state and first-order Raman modes. M. Hanfland, H. Beister, K. Syassen. Physical Review B 39, 12598 (1989).
[8] Light-transparent phase formed by room-temperature compression of graphite. W. Utsumi, T. Yagi. Science 252, 1542 (1991).
[9] Room-temperature compression-induced diamondization of few-layer graphene. A.P.M Barboza et al. Advanced Materials 23, 3014 (2011).
[1] No começo do desenvolvimento da teoria quântica, ficou claro que o elétron possuía uma propriedade importante denominada de spin. A descrição matemática desta grandeza física é relativamente complicada, mas a sua visualização pode ser inferida por experimentos simples. Consideremos um feixe de elétrons, ou um feixe de átomos que possui spin diferente de zero. Este feixe é emitido por um canhão de elétrons e, à princípio, ele se movimentará em linha reta. Entretanto, se os elétrons que foram emitidos penetrarem uma região do espaço onde se encontra um campo magnético não uniforme, os elétrons serão defletidos para um lado ou para o outro num plano perpendicular ao campo magnético (como o elétron também possui um momento magnético, m, associado, o campo não-uniforme implicaria numa distribuição espacial contínua para os elétrons do feixe). Como o momento magnético do elétron é proporcional ao valor do spin, m ~ s, o campo magnético exerce uma influência sobre o elétron através do seu momento magnético que, em última análise, está relacionado ao seu spin. O fato dos elétrons poderem ser separados em dois feixes indica que, para eles, existem dois tipos de spin, um positivo e um negativo. Na linguagem que os físicos gostam de usar:
s = + ħ/2 ou s = - ħ/2,
[2] Química Orgânica.N.I. Allinger, M.P. Cava, D.C. de Jongh, C.R. Johnson, N.A. Lebel, C.L. Stevens, Ed. LTC.
[3] Um espectrômetro, fundamentalmente, separa a luz em diversos comprimentos de onda, cada comprimento de onda associado a uma cor. Depois que essa luz é separada ela é detectada através de um sistema - fotomultiplicadora ou sistema CCD - que é sensível aos vários comprimentos de onda, nos casos mais comuns, abrangendo a região do infravermelho ao ultravioleta, passando pela luz visível.
[4] A unidade cm−1 é a mais utilizada pelos espectroscopistas. A grosso modo, essa unidade corresponde ao inverso do comprimento de onda, ou seja, 1/
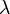 .
.[5] Raman of disordered amorphous and diamondlike carbon, A.C. Ferrari, J. Robertson, Physical Review B 64, 075414 (2001).
[6] Bonding changes in compressed superhard graphite. W.L. Mao et al. Science 302, 425 (2003).
[7] Graphite under pressure: equation of state and first-order Raman modes. M. Hanfland, H. Beister, K. Syassen. Physical Review B 39, 12598 (1989).
[8] Light-transparent phase formed by room-temperature compression of graphite. W. Utsumi, T. Yagi. Science 252, 1542 (1991).
[9] Room-temperature compression-induced diamondization of few-layer graphene. A.P.M Barboza et al. Advanced Materials 23, 3014 (2011).